Gay Lussac era uno scienziato di origine francese, che scoprì che quando due gas reagiscono, i rapporti dei volumi tra i reagenti e i prodotti sono sempre uguali a rapporti tra numeri interi.
Ad esempio un volume di idrogeno reagisce con un volume di cloro dando due volumi di acido cloridrico, secondo la reazione:
H + Cl → HCl
Ancora, due volumi di idrogeno reagiscono con un volume di ossigeno per dare due volumi di acqua, secondo la reazione:
H + O2 → H2O
Prima legge di Gay Lussac: a pressione costante, il volume di un gas aumenta con l'aumentare della temperatura.
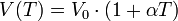
V0 = volume del gas a Temperatura di zero gradi centigradi;
V(T) = volume a una Temperatura maggiore di zero:
Alpha = coefficiente di espansione dei gas (aumento di volume subito da un volume unitario di gas quando la sua temperatura aumenta di 1 ° C).
Se la temperatura presa come riferimento non è espressa in gradi centrigradi ma in gradi Kelvin, la legge diventa:
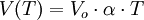
Seconda legge di Gay Lussac: a volume costante la pressione di un gas aumenta all'aumentare della temperatura.

P0 = pressione di un gas a 0° C;
P(T) = pressione a una temperatura maggiore di 0° C;
Alpha = coefficiente di espansione del gas (aumento relativo di pressione del gas quando la sua temperatura aumenta di 1° C).
Se la temperatura è espressa in gradi Kelvin, la legge diventa:
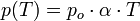
Entrambe queste leggi sono valide a pressioni non troppo elevate e temperature non vicine alla liquefazione del gas. Si tratta quindi di leggi verificate quando un gas si comporta come perfetto (ideale).